2025年9月12日,中国农业大学植物保护学院朱旺升研究团队在国际期刊Nature Plants在线发表题为“An apoplastic fungal effector disrupts N-glycosylation of ZmLecRK1, inducing its degradation to suppress disease resistance in maize"的研究论文。本文借助糖基化修饰鉴定技术,揭示了禾谷镰孢菌的一种“胞外效应子"FgLPMO9A,它可直接靶向胞外免疫受体ZmLecRK1的N-糖基化修饰,促使该受体发生自噬降解,进而抑制玉米的抗病性。蓝景科信为该研究提供了糖基化修饰鉴定检测技术支持。

研究背景
禾谷镰孢菌(Fusarium graminearum)是子囊菌门的一种世界性分布的丝状真菌病原体,是引起小麦、大麦、玉米等主要粮食作物赤霉病和穗腐病的首要病原菌。质外体(植物细胞间隙区域)是植物-病原体互作的核心场所,植物通过胞外免疫受体(如类受体激酶)识别病原菌表面的“入侵信号"(病原菌相关分子模式,PAMPs),激活免疫反应(PAMP触发的免疫,PTI),抵御病原菌入侵。病原体分泌效应子来抑制植物的免疫反应。目前对胞内效应子介导的免疫抑制机制研究较深入,但质外体中发挥作用的“胞外效应子"是否直接靶向胞外免疫受体仍不明确。
团队此前已发现,玉米中的G型凝集素类受体激酶ZmLecRK1是重要的免疫“哨兵",能通过调控活性氧爆发和细胞壁代谢,抵御多种病原菌入侵。但奇怪的是,它对禾谷镰孢菌却“失效"了。团队推测,禾谷镰孢菌可能分泌了特定效应子,专门“沉默"ZmLecRK1的免疫功能——这一猜想,成为了本次研究的起点。
核心发现一:锁定病原菌的关键——效应子FgLPMO9A
为找到禾谷镰孢菌抑制ZmLecRK1的“元凶",团队通过蛋白互作筛选,从禾谷镰孢菌分泌的蛋白中,鉴定出一个关键胞外效应子——FgLPMO9A。
FgLPMO9A属于多糖单加氧酶家族(LPMO),这类蛋白原本被认为主要功能是分解植物细胞壁的多糖(如纤维素),帮助病原菌穿透植物组织。但本研究发现,它还有一个“隐藏技能"——作为效应子抑制植物免疫。
通过基因敲除实验,团队证实:
- 敲除FgLPMO9A的禾谷镰孢菌(Δfglpmo9a)对玉米的致病性显著减弱,接种后玉米茎秆的病斑长度大幅缩短;
- 而当把这种“减毒"病原菌接种到ZmLecRK1基因缺失的玉米突变体(zmlecrk1)上时,病原菌的致病性又恢复。
这一结果清晰表明:FgLPMO9A是禾谷镰孢菌突破玉米免疫的关键,且其作用靶点正是玉米免疫受体ZmLecRK1。

图1 禾谷镰孢菌分泌FgLPMO9A以特异性抑制玉米中ZmLecRK1介导的抗性。
核心发现二:效应子如何“精准打击"免疫受体,瓦解细胞防御
找到后,团队进一步解析了FgLPMO9A攻击ZmLecRK1的分子机制,发现其通过“精准结合+破坏修饰",让ZmLecRK1“失效"。
1. 第一步:锁定ZmLecRK1的“致命位点"
ZmLecRK1的胞外结构域包含三个功能区:B型凝集素结构域、S位点糖蛋白结构域(S-domain)和PAN结构域。通过蛋白互作实验和AlphaFold3结构预测,发现:
- FgLPMO9A会特异性结合ZmLecRK1的S结构域,且关键结合位点是S结构域上的Y294;
- 若将ZmLecRK1的Y294突变为Y294A,FgLPMO9A就无法与其结合,也不能再抑制ZmLecRK1介导的免疫反应。
这意味着,Y294是ZmLecRK1被FgLPMO9A结合的“致命位点"。
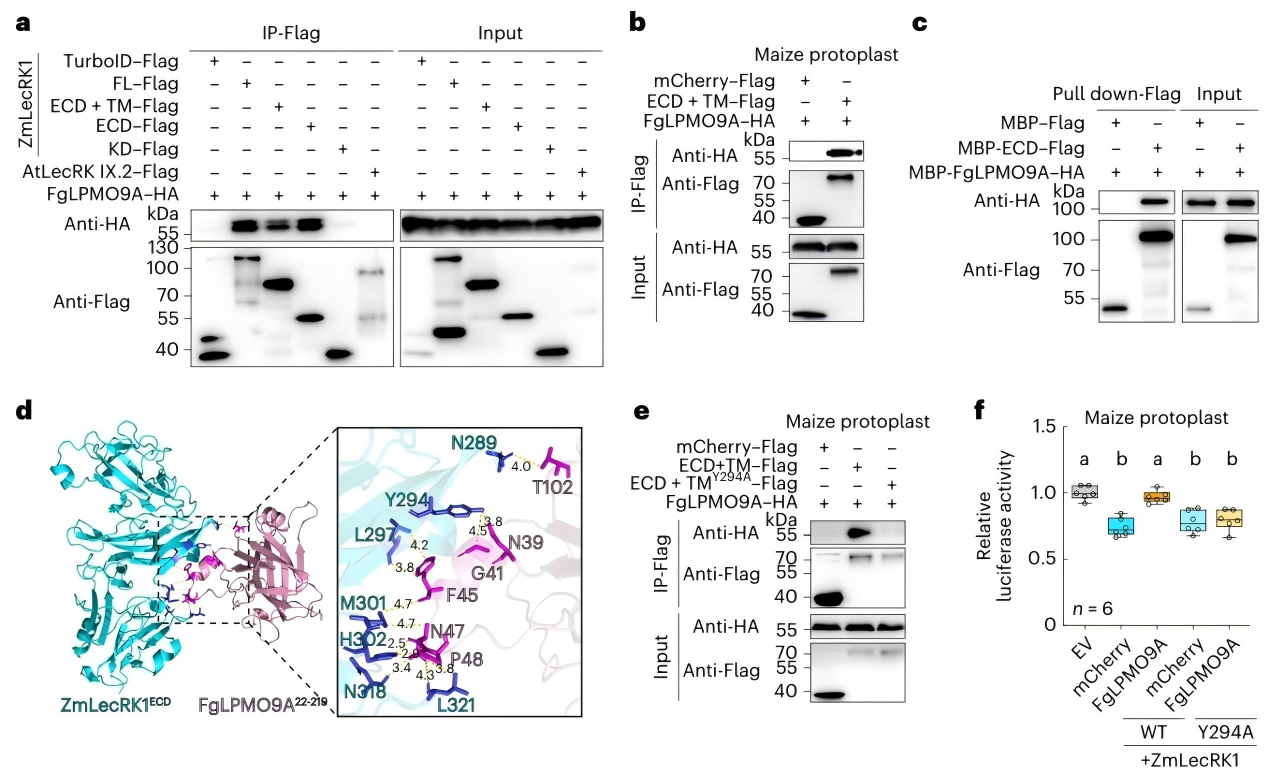
图2 FgLPMO9A与ZmLecRK1 S结构域的Y294相互作用以抑制其活性。
2. 第二步:破坏糖基化修饰,触发受体降解
蛋白质的N-糖基化修饰(在特定天冬酰胺残基上添加糖链)是维持蛋白稳定性和功能的关键“开关"。团队发现,体外糖基化质谱分析结果表明,FgLPMO9A结合ZmLecRK1后,会利用其多糖单加氧酶活性,破坏ZmLecRK1胞外结构域上第341位天冬酰胺(N341)的N-糖基化修饰。
更关键的是,N341的糖基化被破坏后,玉米细胞会启动“自噬降解通路",通过自噬受体NBR1将失活的ZmLecRK1“回收销毁"——相当于FgLPMO9A不仅“缴械"了ZmLecRK1,还触发了玉米自身的“垃圾处理系统",清除这个免疫受体。
通过抑制剂实验验证:当用自噬抑制剂(3-MA)或液泡降解抑制剂(ConA)处理时,ZmLecRK1的降解被显著抑制,其免疫功能也得以恢复,进一步证实了FgLPMO9A通过“破坏糖基化+诱导自噬降解"双重机制抑制ZmLecRK1。
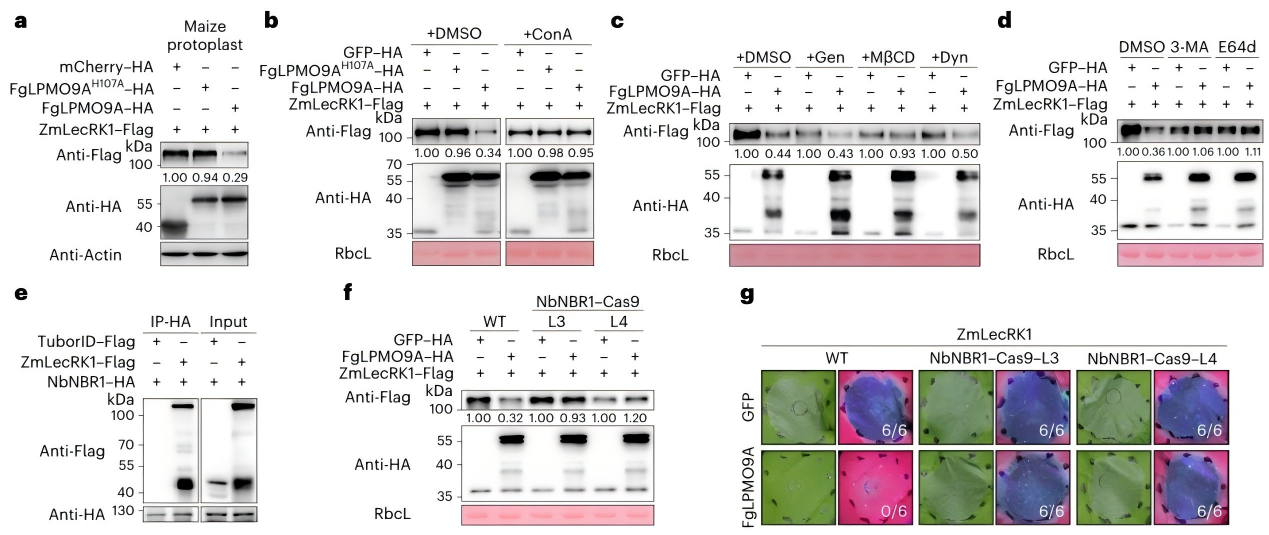
图3 FgLPMO9A介导ZmLecRK1自噬降解。
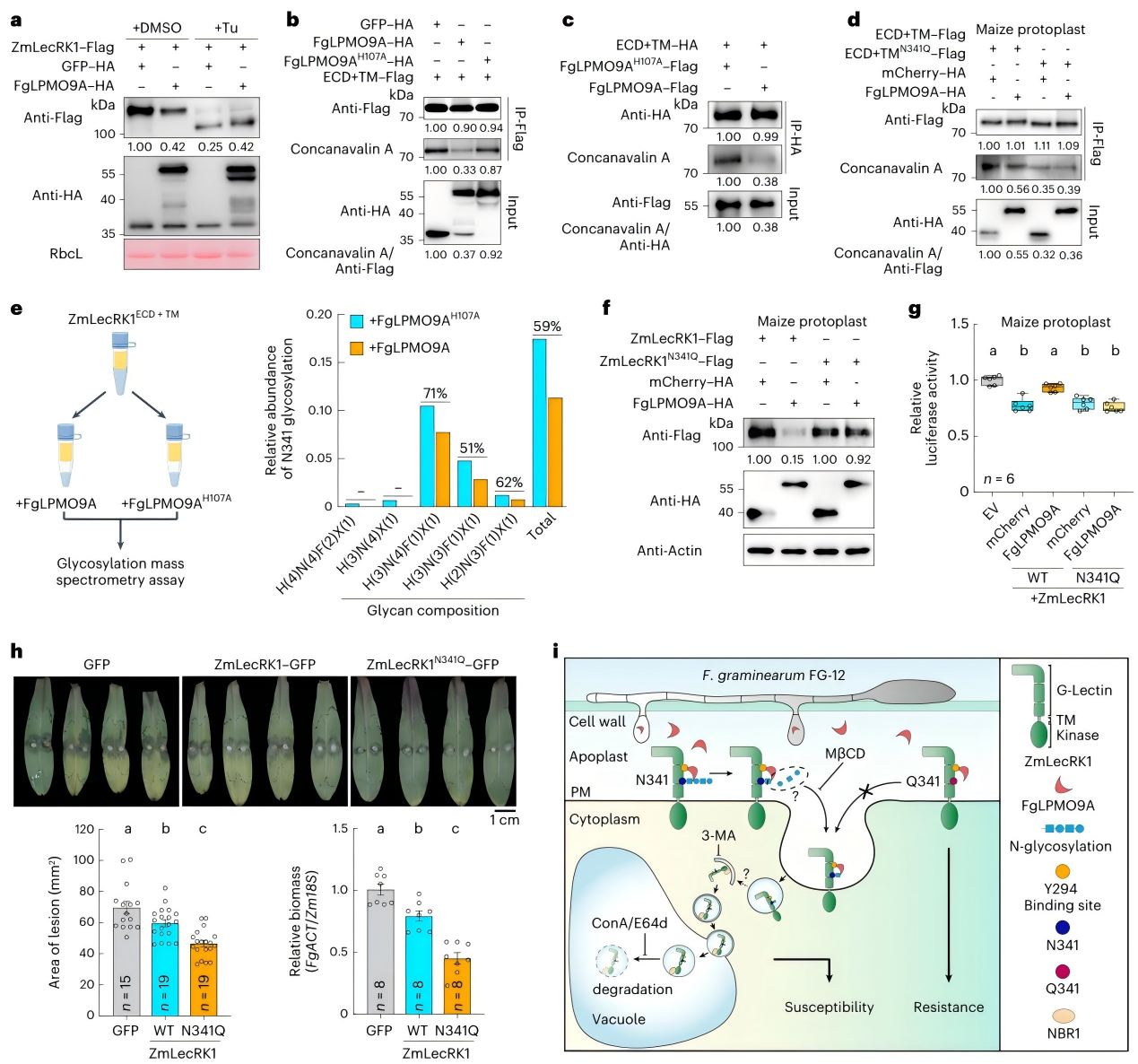
图4 FgLPMO9A破坏ZmLecRK1中N341的N-糖基化以抑制玉米的抗病性。
核心发现三:单点突变让玉米获得“抗病超能力"
既然N341的糖基化修饰是FgLPMO9A攻击ZmLecRK1的“关键靶点",那么能否通过基因编辑让ZmLecRK1避开这种攻击?
团队做了一个关键实验:将ZmLecRK1的N341突变为N341Q——这种突变会模拟N-糖基化缺失的状态,但不会被FgLPMO9A识别和破坏。结果令人振奋:
- 携带ZmLecRK1-N341Q的玉米,在接种禾谷镰孢菌后,病斑面积比野生型玉米减少约40%,病原菌生物量显著降低;
- FgLPMO9A无法再降解ZmLecRK1-N341Q,其介导的免疫反应(如活性氧爆发)得以完整保留。
这一结果表明,ZmLecRK1的N341Q突变是一个理想的抗病靶点——仅需对单个氨基酸进行编辑,就能让玉米获得对禾谷镰孢菌的广谱抗性,且不影响ZmLecRK1对其他病原菌的抗性(因其他抗性相关位点未被改变)。
研究意义
朱旺升团队的这项研究,不仅在基础科学层面打破了人们对胞外效应子功能的传统认知,揭示了“病原菌胞外效应子-植物胞外免疫受体-自噬降解"的全新互作通路,更在农业应用层面提供了抗病育种策略:
1. 精准育种靶点:通过基因编辑(如CRISPR)将玉米ZmLecRK1的N341突变为Q,可快速培育抗赤霉病的玉米新品种,且无需引入外源基因,符合现代生物育种的发展方向;
2. 广谱抗病思路:FgLPMO9A在多种镰孢菌中高度保守(如尖孢镰孢菌、轮枝镰孢菌),这一机制可能适用于其他作物(如小麦、大豆)的镰孢菌病害,为跨作物抗病研究提供参考;
3. 免疫机制拓展:证实自噬通路参与植物胞外免疫受体的降解调控,为解析植物免疫稳态维持机制提供了新视角。
